Estudos de mundo real comprovam eficácia e segurança de lipegfilgrastim no tratamento da neutropenia
Descubra como lipegfilgrastim age no tratamento da neutropenia por meio de estudos da vida real, reduzindo danos e custos durante o processo
Grande parte dos agentes quimioterápicos age em células que estão em divisão celular. Infelizmente, esse mecanismo de ação não é específico de células malignas, resultando em lesão das células saudáveis. O sistema hematopoético é particularmente sensível a essa toxicidade, por produzir aproximadamente um trilhão de células por dia.1
Entre as células do sistema hematopoético, a mais abundante da série branca é o neutrófilo, que tem meia-vida curta (seis a oito horas), com produção diária de 50 a 100 bilhões pela medula óssea.2
A Neutropenia como agravante dos protocolos quimioterápicos
Neutropenia é reconhecidamente uma das toxicidades limitantes de doses de protocolos quimioterápicos.3 Uma das complicações mais frequentes e graves é a neutropenia febril (NF), definida por temperatura oral superior a 38,3ºC ou duas medidas consecutivas maiores que 38ºC por duas horas e contagem absoluta de neutrófilos inferior a 500/mm3, ou quando se espera queda menor que 500/mm3.4

Graus de gravidade da neutropenia febril
Seu grau de gravidade é classificado conforme o critério de toxicidade do National Cancer Institute,5 baseado na contagem absoluta de neutrófilos:
- Grau 1: neutrófilos entre 1.500 e 2.000/mm3.
- Grau 2: neutrófilos entre 1.000 e 1.500/mm3.
- Grau 3: neutrófilos entre 500 e 1.000/mm3.
- Grau 4: neutrófilos abaixo de 500/mm3.
- Grau 5: óbito.
Neutrófilos são um dos principais mediadores do sistema imunológico inato e a primeira linha de defesa contra vários agentes patogênicos, portanto neutropenia grave pode levar a infecções graves,6 estando associada a aumento do risco de infecções oportunistas e febre, tanto por redução do sistema imunológico quanto por alterações de mucosa e microflora intestinal.7
Aumento da taxa de morbidade e mortalidade em pacientes com neutropenia grave e febril
Vários estudos demonstram que neutropenia grave e NF levam ao aumento de morbidade e mortalidade em pacientes com neoplasias em tratamento com quimioterapia mielossupressiva,8,9 incremento do uso de antibióticos endovenosos,10-12 altos custos de internação,13-15 reduções de dose e atrasos de ciclos de quimioterapia.9,16,17
Na década de 1980, o fator estimulador de colônias de granulócitos (G-CSF) teve sua estrutura molecular clonada.18-21 Demonstrou-se que G-CSF estimulava a proliferação e a diferenciação de vários tipos de progenitores mieloides, levando a um aumento no número de neutrófilos maduros.22-26 Em 1991, a Food and Drug Administration (FDA) aprovou o filgrastim, após demonstrar redução de episódios de febre e infecções com o uso de G-CSF em estudos clínicos randomizados, em pacientes oncológicos submetidos à quimioterapia mielossupressora.27, 28 Tais fatores de crescimento se estabeleceram como padrão para profilaxia de NF em quimioterapias de alto risco. Porém, filgrastim necessita de uso diário, o que reduz a aderência ao tratamento.
A combinação de uma molécula de polietilenoglicol (PEG) ao filgrastim reduz sua excreção renal, levando a aumento da meia-vida plasmática do fármaco, reduzindo a necessidade de aplicações diárias.29
O que é lipegfilgrastim?
Lipegfilgrastim é um G-CSF recombinante, peguilado, produzido pela conjugação de uma molécula de PEG de 20-kDa a um sítio de ligação natural do G-CSF, utilizando uma nova tecnologia de glicoPEGlação, resultando em um novo perfil farmacocinético e farmacodinâmico30-32 (Figura 1).
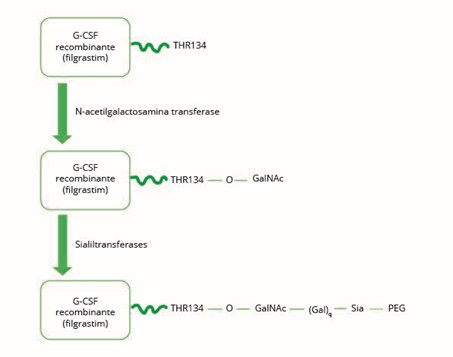
Adaptada de: Hoggatt J, et al., 2015.30
Eficácia comprovada
A eficácia e a segurança de lipegfilgrastim foram avaliadas tanto in vitro quanto in vivo, em pessoas saudáveis.33,34 Nesses estudos se constataram sua eficácia, ao incrementar o número de neutrófilos, e sua longa vida, até mesmo sua maior resistência à degradação pela elastase neutrofílica humana, o que prolonga sua meia-vida quando comparada a pegfilgrastim.35
Características de lipegfilgrastim
Lipegfilgrastim apresenta dois mecanismos de clareamento: uma via linear que envolve degradação proteolítica enzimática e uma via não linear que envolve clareamento mediado por neutrófilos. Em altas concentrações, o mecanismo de eliminação da via neutrofílica é saturado, fazendo a medicação exercer sua função por tempo prolongado. Após uma única dose de 6 mg, em indivíduos saudáveis, lipegfilgrastim apresentou meia-vida de 32 a 62 horas (7 a 10 horas a mais do que o reportado por pegfilgrastim).36 Consistente com esse mecanismo autorregulatório de clareamento, a concentração de lipegfilgrastim se reduz vagarosamente durante a fase inicial de neutropenia após a quimioterapia, com queda rápida da concentração após a recuperação do pool neutrofílico.33
Estudos de vida real com lipegfilgrastim
Levando-se em consideração os custos, a mortalidade, a morbidade e a eficácia do G-CSF, os principais guidelines preconizam o uso profilático dessa classe de medicamentos.
Atualmente, dividem-se os protocolos de quimioterapia em baixo risco (menos de 10% de incidência de NF), risco intermediário (10% a 20%) e alto risco (mais de 20%).16,37
A European Society for Medical Oncology (ESMO)4 indica o uso de G-CSF em profilaxia primária em regimes quimioterápicos de alto risco e em regimes de risco intermediário na presença de comorbidades.
Guideline da American Society of Clinical Oncology (ASCO)38 indica o uso de G-CSF em profilaxia primária em regimes quimioterápicos de alto risco (mais de 20% de risco de NF) e em regimes quimioterápicos dose-densa.
A ASCO38 também indica o uso de G-CSF em profilaxia secundária a pacientes que apresentaram alguma complicação neutropênica em ciclo anterior (quando não receberam profilaxia primária), nos quais redução ou adiamento de dose pode comprometer o resultado do tratamento.
Guideline da National Comprehensive Cancer Network (NCCN)37 segue instruções semelhantes, conforme pode ser visto nas figuras MGF-1 e MGF-2. Além de prever o uso de G-CSF na profilaxia secundária e no uso terapêutico durante o curso de neutropenia febril (MGF-3 e MGF-4).
Mais eficácia no tratamento de neutropenia febril com redução de efeitos colaterais
Uma metanálise em rede bayesiana, comparando 11 diferentes G-CSFs em pacientes em quimioterapia, por vários tipos de neoplasia, englobando mais de 70 estudos e mais de 15 mil pacientes, demonstrou que lipegfilgrastim é um dos mais eficazes em reduzir NF e um dos menos associados a dores ósseas (um dos efeitos colaterais mais comuns com uso de G-CSFs).39
Lipegfilgrastim também foi avaliado em dois estudos fase 4, de mundo real. Um estudo multicêntrico conduzido na Bélgica e em Luxemburgo, um segundo estudo multicêntrico holandês confirmaram a baixa incidência de eventos neutropênicos e perfil de segurança do lipegfilgrastim, sem relato de nenhum efeito colateral novo que não havia sido relatado em estudos pivotais.40,41
Em estudo fase 3, multicêntrico, randomizado, duplo cego, de não inferioridade, com pacientes com neoplasia de mama de alto risco, comparou-se dose única de pegfilgrastim com dose única de lipegfilgrastim. Dados do estudo demonstraram equivalência entre as duas medicações em termos de incidência de NF, duração de neutropenia e efeitos colaterais. Chama a atenção que entre os 101 pacientes do braço de lipegfilgrastim, houve apenas um episódio de NF durante todo o tratamento quimioterápico.42
O estudo NADENS é um estudo alemão, multicêntrico, que avaliou protocolos dose-densa em pacientes com neoplasia de mama, com suporte com lipegfilgrastim.43 Foram analisadas 282 pacientes, com relato de redução de dose por neutropenia em apenas 2,5% das pacientes e 2,1% de episódios de NF.43
Uma metanálise com mais de 5 mil pacientes de 24 diferentes estudos, com vários tipos de neoplasia em tratamento quimioterápico, comparou indiretamente a eficácia de filgrastim, pegfilgrastim e lipegfilgrastim. Os dados coletados demonstraram redução estatisticamente significativa de neutropenia entre os ciclos 2 e 4, nos pacientes que utilizaram lipegfilgrastim, quando comparado tanto a pegfilgrastim quanto filgrastim. Também se constatou redução estatisticamente não significativa no risco de NF ao se utilizar lipegfilgrastim.44
Estudos de vida real comprovam eficácia e segurança de lipegfilgrastim
G-CSFs é uma classe de medicamento adjuvante essencial em pacientes com neoplasia que necessitam de quimioterapia. Associado a antibióticos, suporte transfusional e cuidados intensivos, é um dos fatores seminais que permitiram aumento da intensidade do tratamento quimioterápico, para aumentar a chance de cura e sobrevida global e seu uso é recomendado por todos os guidelines do mundo.
Há uma variedade enorme de estudos com lipegfilgrastim, em vários tumores diversos, com diferentes esquemas terapêuticos, sendo impossível descrever todos eles. Nesta revisão, destacaram-se alguns dos principais estudos, tanto em contexto clínico quanto em mundo real, mas que, de forma alguma, têm a pretensão de esgotar todas as aplicações possíveis de lipegfilgrastim. Todos eles confirmam sua eficácia e segurança, nos mais variados cenários, inclusive com uma metanálise demonstrando sua superioridade em relação ao filgrastim e pegfilgrastim.
Referências bibliográficas
- Ogawa M. Differentiation and proliferation of hematopoietic stem cells. Blood. 1993;81(11):2844-53.
- Summers C, Rankin SM, Condliffe AM, Singh N, Peters AM, Chilvers ER. Neutrophil kinetics in health and disease. Trends Immunol. 2010; 31(8):318-24.
- Holmes FA, O’Shaughnessy JA, Vukelja S, Jones ES, Shogan J, Savin M, et al. Blinded, randomized, multicenter study to evaluate single administration pegfilgrastim once per cycle versus daily filgrastim as an adjunct to chemotherapy in patients with high- risk stage II or stage III/IV breast cancer. J Clin Oncol. 2002;20:727-31.
- Klastersky J, Naurois J, Rolston K, Rapoport B, Maschmeyer G, Aapro M, Herrstedt J on behalf of the ESMO Guidelines Committee. Management of febrile neutropaenia: ESMO Clinical Practice Guidelines. Annals of Oncology 2016;27 (suppl.): v111-v118.
- Common Terminology Criteria for Adverse Events (CTCAE). https://ctep.cancer.gov/protocoldevelopment/electronic_applications/ctc.htm. Acesso em: 6 jul 2023.
- Nesher L, Rolston KV. The current spectrum of infection in cancer patients with chemotherapy related neutropenia. Infection. 2014;42(1):5-13.
- Bennett CL, Djulbegovic B, Norris LB, Armitage JO. Colony-stimulating factors for febrile neutropenia during cancer therapy. N Engl J Med 2013;368:1131-9
- Kuderer NM, Dale DC, Crawford J, Cosler LE, Lyman GH. Mortality, morbidity, and cost associated with febrile neutropenia in adult cancer patients. Cancer. 2006;106(10):2258-66.
- Pfeil AM, Allcott K, Pettenge llR, von Minckwitz G, Schwenkglenks M, Szabo Z. Efficacy, effectiveness and safety of long-acting granulocyte colony-stimulating factors for prophylaxis of chemotherapy-induced neutropenia in patients with cancer: a systematic review. Support Care Cancer. 2015;23(2):525-45.
- Bodey GP, Buckley M, Sathe YS, Freireich EJ. Quantitative relationships between circulating leukocytes and infection in patients with acute leukemia. Ann Intern Med. 1966;64:328-40.
- Freifeld AG, Bow EJ, Sepkowitz KA, Boeckh MJ, Ito JI, Mullen CA, et al. Clinical practice guideline for the use of antimicrobial agents in neutropenic patients with cancer: 2010 update by the Infectious Diseases Society of America. Clin Infect Dis 2011;52(4):e56-93.
- Holmes FA, Jones SE, O’Shaughnessy J, Vukelja S, George T, Savin M, et al. Comparable efficacy and safety profiles of once-per-cycle pegfilgrastim and daily injection filgrastim in chemotherapy-induced neutropenia: a multicenter dose-finding study in women with breast cancer. Ann Oncol. 2002;13(6):903-9.
- Caggiano V, Weiss RV, Rickert TS, Linde-Zwirble WT. Incidence, cost and mortality of neutropenia hospitalization associated with chemotherapy. Cancer. 2005;103(9):1916-24.
- Michels SL, Barron RL, Reynolds MW, Tomic KS, Yu J, Lyman GH. Costs associated with febrile neutropenia in the US. Pharmacoeconomics. 2012;30(9):809-23.
- Schilling MB, Parks C, Deeter RG. Costs and outcomes associated with hospitalized cancer patients with neutropenic complications: a retrospective study. Exp Ther Med. 2011;2(5):859-66.
- Aapro MS, Bohlius J, Cameron DA, Dal Lago L, Donnelly JP, Kearney N, et al. for European Organisation for Research and Treatment of Cancer. 2010 update of EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours. Eur J Cancer. 2011;47(1):8-32.
- Lyman GH. Impact of chemotherapy dose intensity on cancer patient outcomes. J Natl Compr Canc Netw. 2009;7(1):99-108.
- Nagata S, Tsuchiya M, Asano S, Yamamoto O, Hirata Y, Kubota N, et al. The chromosomal gene structure and two mRNAs for human granulocyte colony-stimulating factor. EMBO J. 1986;5(3):575-81.
- Platzer E, Oez S, Welte K, et al. Human pluripotent hemopoietic colony stimulating factor: activities on human and murine cells. Immunobiology. 1986;172(3-5):185-93.
- Souza LM, Boone TC, Gabrilove J, Lai PH, Zsebo KM, Murdock DC, et al. Recombinant human granulocyte colony-stimulating factor: effects on normal and leukemic myeloid cells. Science. 1986;232(4746):61-5.
- Welte K, Platzer E, Lu L, Gabrilove JL, Levi E, Mertelsmann R, et al. Purification and biochemical characterization of human pluripotent hematopoietic colony-stimulating factor. Proc Natl Acad Sci USA. 1985;82(5):1526-30.
- Dührsen U, Villeval JL, Boyd J, Kannourakis G, Morstyn G, Metcalf D. Effects of recombinant human granulocyte colony-stimulating factor on hematopoietic progenitor cells in cancer patients. Blood. 1988;72(6):2074-81.
- Welte K, Bonilla MA, Gillio AP, Boone TC, Potter GK, Gabrilove JL, et al. Recombinant human granulocyte colony-stimulating factor. Effects on hematopoiesis in normal and cyclophosphamide-treated primates. J Exp Med. 1987;165(4):941-8.
- Ikebuchi K, Ihle JN, Hirai Y, Wong GG, Clark SC, Ogawa M. Synergistic factors for stem cell proliferation: further studies of the target stem cells and the mechanism of stimulation by interleukin-1, interleukin-6, and granulocyte colony-stimulating factor. Blood. 1988;72(6):2007-14.
- Ikebuchi K, Clark SC, Ihle JN, Souza LM, Ogawa M. Granulocyte colony-stimulating factor enhances interleukin 3-dependent proliferation of multipotential hemopoietic progenitors. Proc Natl Acad Sci U S A. 1988;85(10):3445-9.
- Metcalf D, Nicola NA. Proliferative effects of purified granulocyte colony-stimulating factor (G-CSF) on normal mouse hemopoietic cells. J Cell Physiol. 1983;116(2):198-206.
- Crawford J, Ozer H, Stoller R, Johnson D, Lyman G, Tabbara I, et al. Reduction by granulocyte colony-stimulating factor of fever and neutropenia induced by chemotherapy in patients with small-cell lung cancer. N Engl J Med. 1991;325(3):164-70.
- Heil G, Hoelzer D, Sanz MA, Lechner K, Yin JAL, Papa G, et al. A randomized, double-blind, placebo-controlled, phase III study of filgrastim in remission induction and consolidation therapy for adults with de novo acute myeloid leukemia. The International Acute Myeloid Leukemia Study Group. Blood. 1997;90(12):4710-8.
- Yang BB, Kido A. Pharmacokinetics and pharmacodynamics of pegfilgrastim. Clin Pharmacokinet 2011;50(5):295-306.
- Hoggatt J, Tate TA, Pelus LM. Role of lipegfilgrastim in the management of chemotherapy-induced neutropenia. Int J Nanomedicine. 2015;10:2647-52.
- Abdolzade-Bavil A, Cooksey B, Scheckermann C, et al. Pegylated versus glycopegylated G-CSFs and their biochemical and physiological properties. Blood. 2013;122:4851
- Mahlert F, Schmidt K, Allgaier H, Liu P, Müller U, Shen WD. Rational development of lipegfilgrastim, a novel long-acting granulocyte colony-stimulating factor, using glycopegylation technology. Blood. 2013;122(21):4853.
- European Medicines Agency Product Information: Lonquex. 2015. Disponível em: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/002556/ WC500148380.pdf. Acesso em: 6 jul 2023.
- Buchner A, Lammerich A, Abdolzade-Bavil A, Muller U, Bias P. Lipegfilgrastim: pharmacodynamics and pharmacokinetics for body-weight-adjusted and 6 mg fixed doses in two randomized studies in healthy volunteers. Curr Med Res Opin. 2014;30(12):2523-33.
- Abdolzade-Bavil A, von Kerczek A, Cooksey BA, Kaufman T, Krasney PA, Pukac L, et al. Differential sensitivity of lipegfilgrastim and pegfilgrastim to neutrophil elastase correlates with differences in clinical pharmacokinetic profile. J Clin Pharmacol. 2016;56(2):186-94
- Theyab A, Alsharif KF, Alzahrani KJ, Oyouni AAA, Hawsawi YM, Algahtani M, et al. New insight into strategies used to develop long-acting G-CSF biologics for neutropenia therapy. Front Oncol. 2023;12:1026377.
- NCCN guidelines: hematopoietic growth factors. Version 2.2023. March 6, 2023. Disponível em: https://www.nccn.org/professionals/physician_gls/pdf/growthfactors.pdf. Acesso em: 6 jul 2023.
- Smith TJ, Bohlke K, Lyman GH, Carson KR, Crawford J, Cross SJ, et al.; American Society of Clinical Oncology. Recommendations for the Use of WBC Growth Factors: American Society of Clinical Oncology Clinical Practice Guideline Update. J Clin Oncol. 2015 Oct 1;33(28):3199-212
- Wang Y, Chen L, Liu F, Zhao N, Xu L, Fu B, et al. Efficacy and tolerability of granulocyte colony-stimulating factors in cancer patients after chemotherapy: A systematic review and Bayesian network meta-analysis. Sci Rep. 2019;9(1):15374
- Timmer-Bonte JNH, Ouwerkerk J, Faber LM, Kerkhofs LGM, Laterveer L, Ten Oever D, et al. Lipegfilgrastim for prophylaxis of chemotherapy-induced neutropenia in Dutch patients. Neth J Med. 2020;78(5):270-6.
- Fontaine C, Claes N, Graas MP, Samani KK, Vuylsteke P, Vulsteke C. Effect of lipegfilgrastim administration as prophylaxis of chemotherapy-induced neutropenia on dose modification and incidence of neutropenic events: real-world evidence from a non-interventional study in Belgium and Luxembourg. Acta Clin Belg. 2021 Feb;76(1):10-15
- Bondarenko I, Gladkov OA, Elsaesser R, Buchner A, Bias P. Efficacy and safety of lipegfilgrastim versus pegfilgrastim: a randomized, multicenter, active-control phase 3 trial in patients with breast cancer receiving doxorubicin/docetaxel chemotherapy. BMC Cancer. 2013;13:386.
- Kiechle M, Schem C, Lüftner D, Hipp J, Stetzer E, Köhler U. Prophylaxis of neutropenia with lipegfilgrastim in breast cancer patients with dose-dense chemotherapy: results of a noninterventional study on therapeutic routine in Germany (NADENS). Breast Care (Basel). 2022;17(5):508-13.
- Bond TC, Szabo E, Gabriel S, Klastersky J, Tomey O, Mueller U, et al. Meta-analysis and indirect treatment comparison of lipegfilgrastim with pegfilgrastim and filgrastim for the reduction of chemotherapy-induced neutropenia-related events. J Oncol Pharm Pract. 2018;24(6):412-23.